
2025年6月2日,科济药业宣布舒瑞基奥仑赛注射液(satri-cel)在中国开展的针对Claudin18.2阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌患者的确证性II期临床试验(CT041-ST-01, NCT04581473)的研究结果已全文发表在《柳叶刀》(《The Lancet》),并于2025年美国临床肿瘤学会(ASCO)年会进行了口头报告。
这项被专家誉为“里程碑”的试验中,接受satri-cel CAR-T细胞疗法治疗的晚期胃癌或胃食管连接部 (GEJ) 癌患者的平均寿命比接受标准治疗的患者长约40%。

satri-cel是一款潜在全球同类首创的、靶向Claudin18.2蛋白的自体CAR-T细胞治疗候选产品,用于治疗Claudin18.2阳性实体瘤,主要治疗胃/食管胃结合部腺癌及胰腺癌。
CT041-ST-01试验旨在研究satri-cel 对胃癌或胃食管交界处癌的疗效和安全性,是全球首个针对实体瘤的CAR-T细胞疗法随机对照试验。主要终点为盲态独立评审委员会评估的无进展生存期,关键次要终点为总生存期。
在该试验中,共有156例受试者以2:1的比例随机分配至舒瑞基奥仑赛注射液组(satri-cel/CT041组)或研究者选择治疗组(TPC组)。舒瑞基奥仑赛注射液组受试者将接受CT041输注(250×106 /次,最多3次输注)。TPC组受试者将根据研究者评估,接受一种标准治疗(SOC)药物(包括阿帕替尼、紫杉醇、多西他赛、伊立替康或纳武利尤单抗)。TPC组受试者如出现疾病进展或药物不耐受,根据研究者判断可接受后续的CT041治疗。
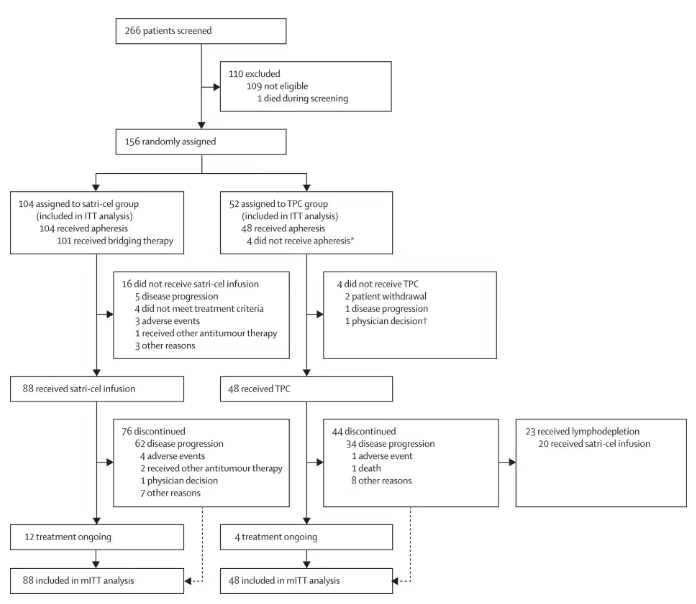
试验概况
结果显示在ITT人群中:基于IRC评价,satri-cel较对照组可显著延长PFS(mPFS 3.25个月 vs 1.77个月;HR=0.37,95%CI: 0.24-0.56;P<0.0001),达到本试验的主要终点。同时OS显示出明显的获益趋势(mOS 7.92个月 vs 5.49个月;HR=0.69,95%CI: 0.46-1.05;单侧P=0.0416)。即便在satri-cel组15.4%(16例)未能接受细胞输注、TPC组近40%(20例)后续接受satri-cel输注的情况下,CT041组患者死亡风险下降仍超过30%。
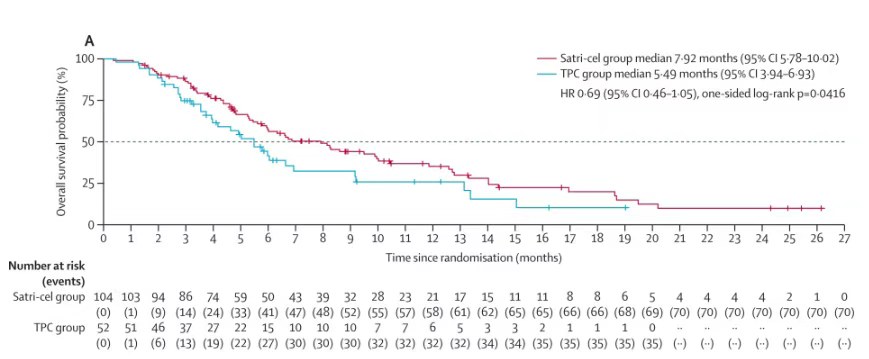
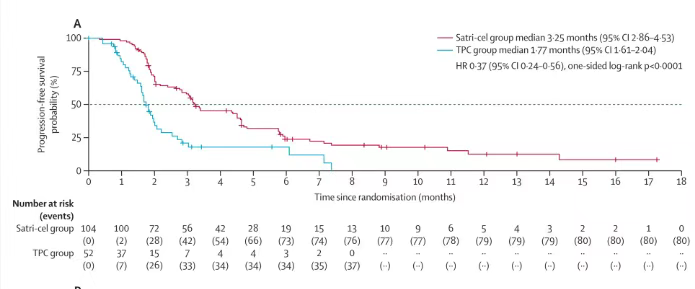
在mITT即实际用药人群中,两组接受试验药物的受试者共136例,其中CT041组88例和TPC组48例。CT041组和TPC组基于IRC评价的mPFS为4.37个月 vs 1.84个月,患者疾病进展/死亡风险下降70%;mOS为8.61个月 vs 5.49个月,死亡风险下降40%。以上结果显示,在实际接受了细胞输注的患者中,CT041的治疗获益更加明显。
安全性方面,satri-cel治疗的整体耐受性良好,3级细胞因子释放综合症(CRS)仅4例,未观察到3级以上的CRS,未观察到免疫效应细胞相关神经毒性综合征(ICANS)。
综上所述,在这项多中心、随机、II期研究中,与TPC相比,satri-cel可显著提高无进展生存期,并显著提高具有临床意义的总生存期,且对于既往接受过治疗的CLDN18.2阳性晚期胃癌或胃食管交界处癌患者而言,satri-cel的安全性可控。在全球范围内,这是首个针对实体瘤的CAR-T细胞疗法的随机对照研究,也是首个证明CAR-T细胞疗法优于标准治疗的研究。这些数据表明,satri-cel可能成为该类患者群体的一种新的治疗选择,并为继续研究satri-cel在晚期胃癌或胃食管交界处癌患者早期治疗中的应用提供了强有力的依据。
参考资料:Qi C, Liu C, Peng Z, et al. Claudin-18 isoform 2-specific CAR T-cell therapy (satri-cel) versus treatment of physician’s choice for previously treated advanced gastric or gastro-oesophageal junction cancer (CT041-ST-01): a randomised, open-label, phase 2 trial. The Lancet 2025; DOI:10.1016/S0140-6736(25)00860-8.
想要解锁更多药企信息吗?查询tyc7111cc太阳成集团(原药融云)数据库(vip.ybspc.cn/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!











































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论