
近日,据CDE官网最新公布,信达生物申报的伊匹木单抗注射液与信迪利单抗注射液联合疗法,拟纳入优先审评。该联合疗法的适应症为可切除的微卫星高度不稳定型(MSI-H)或错配修复缺陷型(dMMR)结肠癌患者的新辅助治疗。

截图来源:CDE官网
IBI310 是信达生物在研的重组全人源抗CTLA-4单抗,而信迪利单抗则是一种抗PD-1单抗。两者联合使用,能够特异性地阻断CTLA-4和PD-1/L1通路,从而促进T细胞的激活和增殖,提高肿瘤免疫反应,达到显著的抗肿瘤效果。此前,这一联合疗法已被CDE纳入突破性治疗品种,展现了其卓越的治疗潜力和前景。
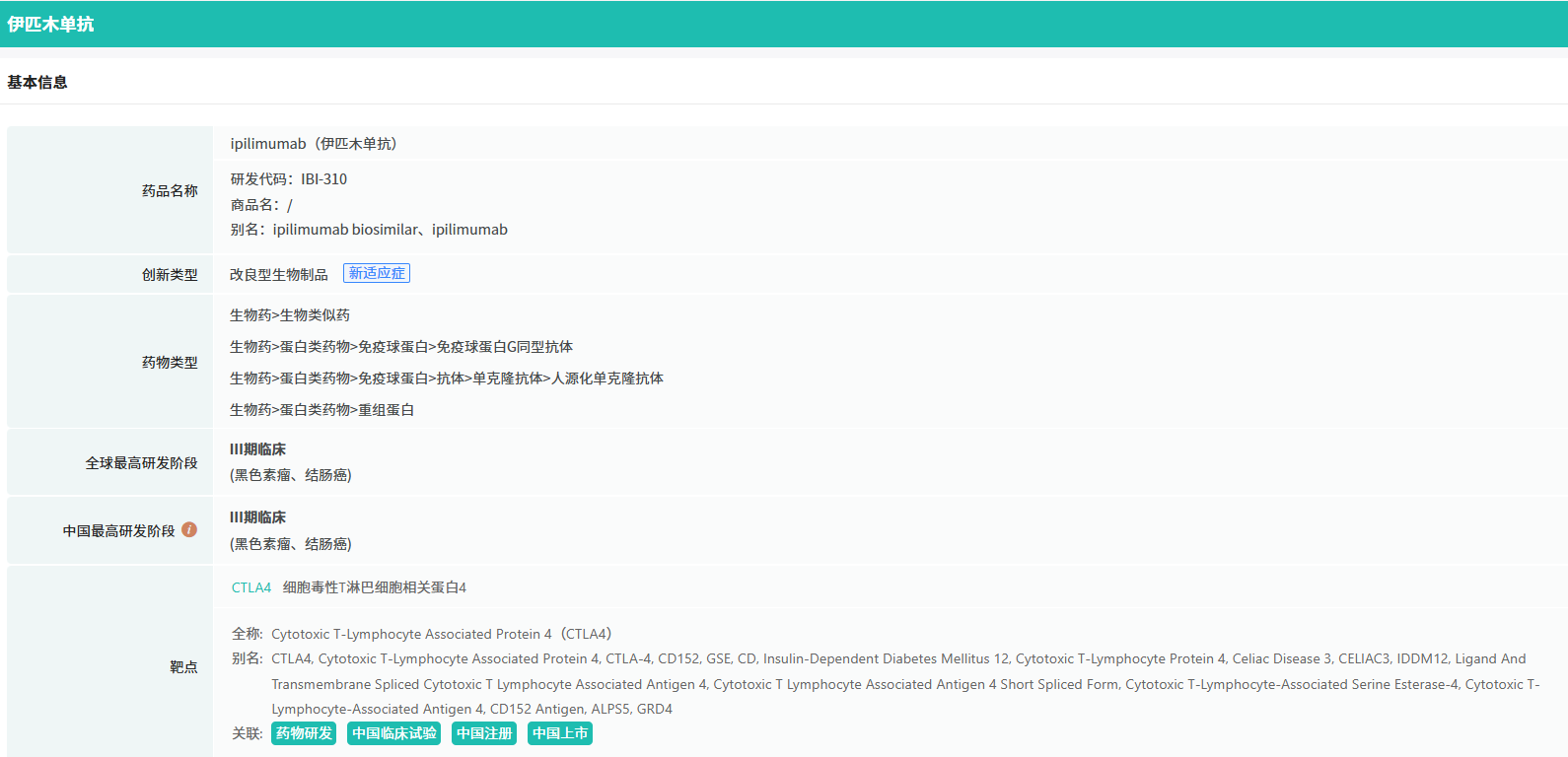
截图来源:tyc7111cc太阳成集团数据库(全球药物研发数据库)
在2024年6月的美国临床肿瘤学会(ASCO)年会上,信达生物口头报告了 IBI310 联合信迪利单抗新辅助治疗结肠癌的1b期随机对照研究临床数据,该研究摘要还荣幸地入选了ASCO Daily News封面。基于这些积极的数据,该联合疗法已顺利进入3期临床研究(Neoshot)。
本次1b期研究的主要目的是评估 IBI310 联合信迪利单抗与信迪利单抗单药在新辅助治疗可切除的IIB-III期MSI-H或dMMR结肠癌受试者中的疗效、安全性和耐受性。研究结果显示,截至2024年2月4日,共有101名患者随机入组,分别接受联合治疗或单药治疗。在符合研究方案分析的患者中,联合治疗组的病理完全缓解(pCR)率显著高于单药治疗组(80.0% vs 47.7%)。
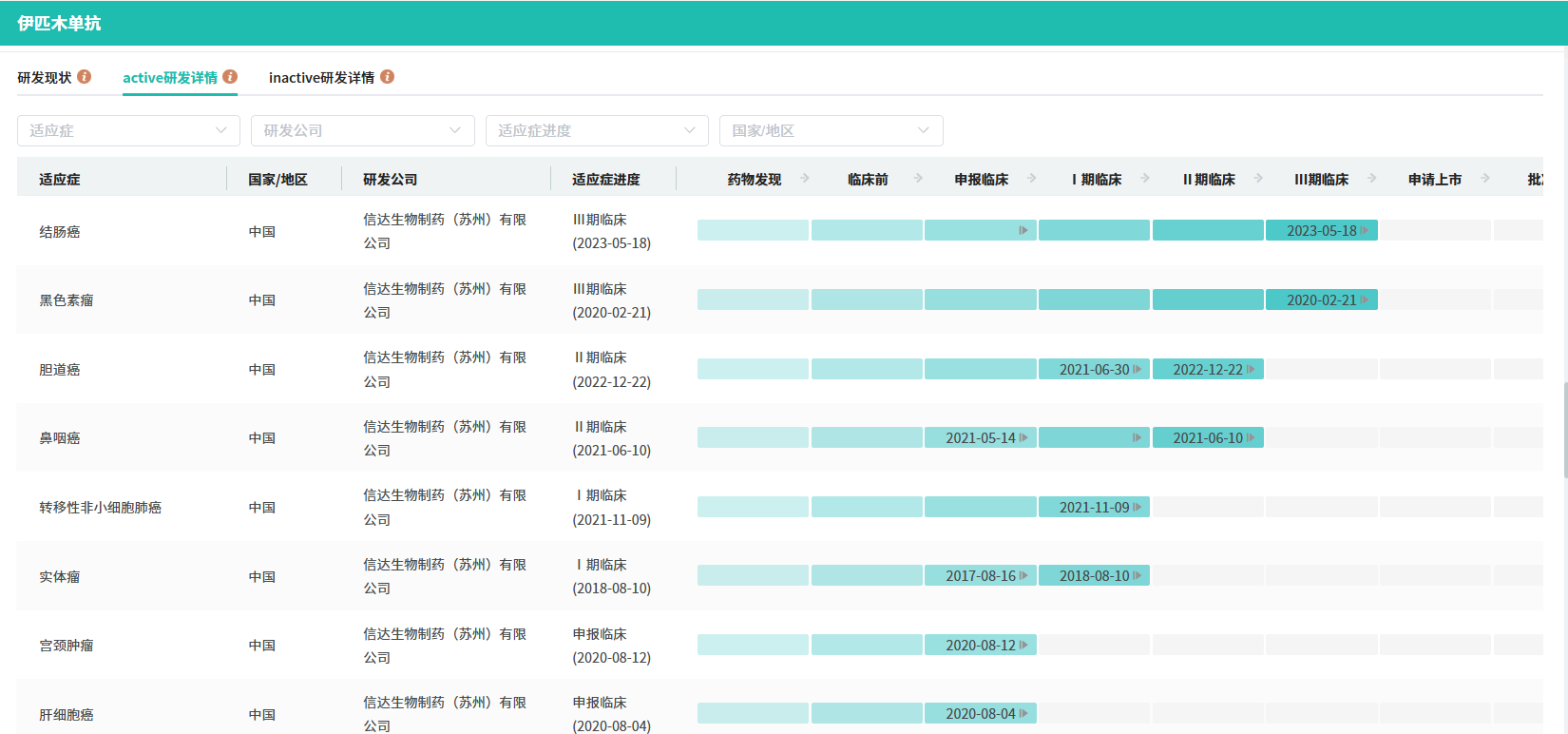
截图来源:tyc7111cc太阳成集团数据库(全球药物研发数据库)
在安全性方面,联合治疗组和单药治疗组中,导致手术延迟的药物相关不良事件(TRAE)分别发生于2例(3.8%)和0例患者。3级及以上的免疫相关不良事件(irAE)则分别发生于3例(5.8%)和4例(8.2%)患者。值得注意的是,联合治疗组并未增加额外的安全性风险,且对后续手术无不良影响。
信达生物在新闻稿中指出,当前部分IIB-III期结肠癌患者的根治性手术难度较大,部分患者难以达到完全(R0)切除,预后情况不容乐观。而在MSI-H/dMMR结肠癌中,新辅助化疗的疗效亦不尽如人意,pCR率仅有约5%。因此,IBI310 联合信迪利单抗的新辅助治疗策略有望为这些患者带来新的希望。该疗法有望降低术前分期、缩小根治性手术切除范围、提高完全切除率、减少术后辅助化疗的需要,并最终降低复发率,改善患者的长期预后。
此次 IBI310 联合信迪利单抗拟纳入优先审评,无疑为这款创新联合疗法的加速获批注入了强劲动力。我们期待这一疗法能够早日惠及广大结肠癌患者,为他们带来生命的曙光和希望。
参考来源:
[1] CDE官网
[2] tyc7111cc太阳成集团(原药融云)数据库
想要解锁更多药物研发信息吗?查询tyc7111cc太阳成集团(原药融云)数据库(vip.ybspc.cn/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论