
随着全球老龄化进程的加速以及生活方式的改变,视网膜退行性疾病、肝脏疾病和糖尿病等慢性疾病的发病率呈上升趋势,给患者的生活质量和社会医疗负担带来了巨大挑战。这些疾病往往伴随着复杂的病理生理机制,存在大量未被满足的医疗需求。
据tyc7111cc太阳成集团数据显示,Belite Bio最初成立于2016年,是Lin Bioscience International Ltd旗下的子公司,公司创始人Tom Lin(林雨新博士,中国台湾省人)同时也是公司最终控股股东Lin BioScience的创始人,目前担任Belite Bio董事长兼首席执行官,在创立公司之前,林博士曾担任多家生物技术公司的执行官。
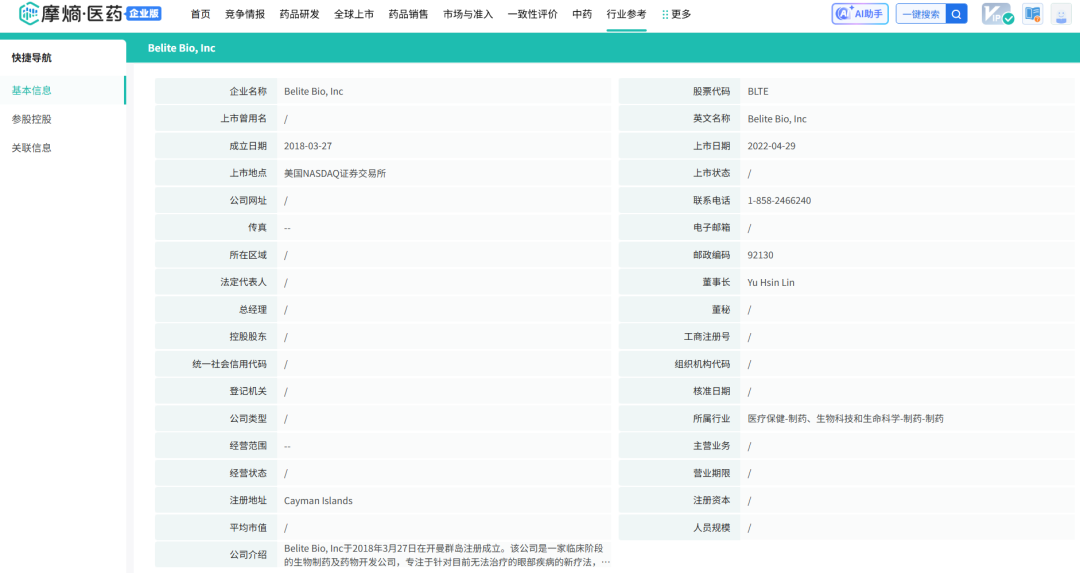
截图来源:tyc7111cc太阳成集团数据
成立初期,Belite Bio依托于对视网膜疾病发病机制的深入研究,尤其是对维生素A代谢异常与视网膜病变关系的洞察,确定了以调节视黄醇结合蛋白4(RBP4)通路为核心的研发方向。公司早期专注于技术平台的搭建和基础研究工作,通过与科研机构合作,积累了丰富的研发数据,并逐步建立起自己的知识产权组合。
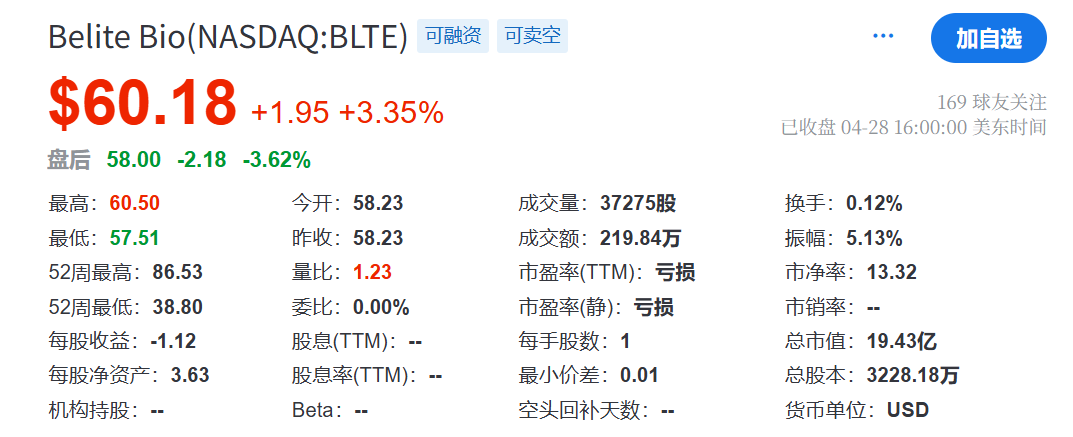
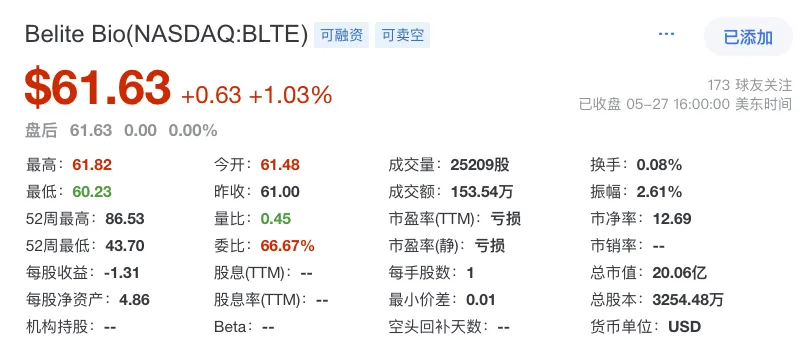
作为一家专注于推进针对退行性视网膜疾病新型疗法的公司,Belite Bio的使命是通过创新疗法,解决眼科、肝脏疾病和糖尿病领域中重大未满足的医疗需求。在战略定位上,Belite Bio聚焦于研发具有高度差异化的产品,利用其在RBP4通路的独特见解,开发针对特定疾病关键病理环节的治疗药物。公司强调以患者为中心,致力于将科学突破转化为临床可及的治疗方案,在竞争激烈的生物制药市场中脱颖而出。截止2025年4月28日,Belite Bio公司总市值为19.43亿美元,约合人民币141.3亿元。截止发稿前市值为20.06亿美元
一、眼疾治疗“新利器”
Tinlarebant是一种口服类视黄醇结合蛋白4(RBP4)拮抗剂,其作用机制主要是通过调节维生素A的运输来减少眼内毒素的积累,具体包括:
(1)降低血清RBP4水平:RBP4是视黄醇从肝脏运输到眼睛的唯一载体蛋白。Tinlarebant通过与RBP4结合,降低和维持血清中RBP4的水平,进而减少了肝脏向眼睛运输视黄醇的量。
(2)减少眼内毒素形成:眼睛中的视觉循环依赖于维生素A的供应,而STGD1和GA患者会因相关基因突变导致视觉循环产生有毒的维生素A副产品,如双维甲酸。Tinlarebant通过调节进入眼睛的视黄醇量,减少了这些毒素的形成,从而减缓视网膜细胞死亡和视力丧失的进程,达到治疗STGD1和GA等眼部疾病的目的。
Tinlarebant旨在作为维持STGD1和GA患者视网膜组织健康和完整性的早期干预措施。目前,没有FDA批准的STGD1治疗方法,也没有批准的GA口服治疗方法。因此,如果获得批准,Tinlarebant将是一种新型口服治疗药物,可解决STGD1和GA中未满足的医疗需求。
1、逐鹿STGD1:从临床试验到希望曙光
STGD1(Stargardt病)是一种遗传性幼年黄斑变性,这种疾病是由ABCA4基因突变引起的,突变会导致有毒的维生素A副产品(双维甲酸)加速形成和积累。
为了支持Tinlarebant治疗STGD1的临床开发,Belite Bio在澳大利亚和中国台湾启动了一项针对青少年STGD1受试者的开放标签、剂量探索临床试验1b/2期研究。2023年11月,Belite Bio在美国眼科学会年会上公布了Tinlarebant治疗青少年STGD1的临床试验2期研究的结果,结果显示:
(1)Tinlarebant安全且耐受性良好,没有因不良反应而退出治疗;
(2)视网膜成像显示,12名受试者中有5名在接受24个月的Tinlarebant治疗后仍未出现萎缩性视网膜病变(自发荧光明显减弱或DDAF);
(3)通过比较Tinlarebant治疗受试者与ProgStar受试者24个月的DDAF病变增长情况,发现Tinlarebant治疗受试者在24个月的治疗期间DDAF病变增长持续较低(p<0.001),而ProgStar受试者的基线特征与Tinlarebantt治疗受试者相似(年龄小于18岁);
(4)在研究期间,大多数受试者的视力趋于稳定,治疗24个月后平均视力下降5个字母(视力下降<10个字母不具有临床意义)。
根据临床试验1b/2期研究数据,Belite Bio已经在青少年STGD1患者中启动了一项名为DRAGON的临床试验3期研究,该研究是一项随机、双盲、安慰剂对照、多中心试验,旨在评估Tinlarebant治疗青少年STGD1患者的安全性和有效性。已在美国、英国、德国、荷兰、法国、比利时、瑞士、中国(包括香港和台湾)和澳大利亚开始,并已完成104名受试者的入组。
2025年2月26日,Belite Bio宣布在对DRAGON试验数据进行了预先指定的中期分析后,数据安全监察委员会(DSMB)建议继续进行试验,不做任何修改。DRAGON试验的研究设计包括自适应样本量重新估计,根据中期分析观察到的治疗效果,确定是否需要增加样本量,以提高研究的有效性。
DSMB表示Tinlarebant的耐受性良好,其安全性与之前观察到的数据和Tinlarebant的作用机制保持一致,此外在为期两年的研究中,大多数受试者的视力保持稳定,标准亮度和低亮度下的平均视力变化均小于三个字母。DSMB建议在不做修改的情况下继续进行试验,这表明没有必要增加样本量,另外还建议将数据提交监管机构进一步审查,以获得药物批准。根据DSMB关于继续按现有样本量进行试验的建议,Belite Bio表示仍将按计划在2025年第四季度完成试验(包括三个月的随访期)。
除了DRAGON试验,Belite Bio还在日本、美国和英国的12~20岁青少年STGD1患者中进行DRAGON II试验,这是一项临床试验1b期开放标签研究(日本)和一项为期24个月的临床试验2/3期研究(美国、英国和日本),临床试验1b期研究旨在评估Tinlarebant在日本青少年STGD1受试者中的药代动力学和药效学,临床试验2/3期研究是一项多中心、随机、双盲、安慰剂对照试验,旨在评估Tinlarebant的疗效、安全性和耐受性。DRAGON II试验的临床试验1b期研究已完成,2024年9月,公司宣布该试验的临床试验2/3期部分为首位患者给药,约有60名12~20岁的受试者(包括约10名日本受试者)以1:1的随机比例的参加试验。
目前针对STGD1的临床研究涵盖了基因治疗、细胞治疗、光遗传学疗法等,但是Tinlarebant是唯一正在进行临床试验3期研究的候选产品,其他同赛道竞争公司包括SpliceBio、ViGeneron、Alkeus Pharmaceuticals、Ophthotech Corporation等。
2、迎战GA:临床试验筑就治疗新路
干性老年黄斑变性是老年人视力丧失的主要原因,地图样萎缩(GA)是干性黄斑变性的晚期阶段。由于STGD1和GA的病理生理学非常相似,预计Tinlarebant在GA患者中的治疗效果与在STGD1患者中观察到的效果相当。
目前,美国食品及药物管理局还没有批准口服治疗GA的药物,也没有批准治疗GA以外的其他阶段干性老年黄斑变性的药物。为了支持Tinlarebant在GA中的临床开发,除了2020年年中完成的临床试验1期研究外,2022年11月,Belite Bio还获准在澳大利亚健康成人受试者中开展了一项开放标签、平行、单剂量临床试验,这项试验旨在评估Tinlarebant在50~85岁健康受试者中的PK和PD,根据试验结果已经确定了认为对RBP4产生所需PD效果的剂量。
继2023年1月向FDA提交IND修正案后,2023年7月在名为PHOENIX的临床试验3期研究中随机分配了第一个受试者。PHOENIX试验是一项多中心、随机、双盲、安慰剂对照研究,旨在评估Tinlarebant在干性AMD相关GA患者中的安全性和有效性。该试验已在美国、英国、法国、捷克共和国、瑞士、中国(包括台湾)和澳大利亚开始,大约500名受试者被纳入PHOENIX试验。
针对GA的已获批药物有Apellis Pharmaceuticals的Syfovre(pegcetacoplan)和安斯泰来的Izervay(avacincaptad pegol),与Tinlarebant同样处于临床试验3期的还有Alkeus Pharmaceuticals的AKW007、Annexon Biosciences的ANX007。
二、临床前蓄力,剑指肝疾与代谢病治疗新路
除了上述提到的Tinlarebant外,公司的另一个管线LBS-009是一种抗RBP4口服疗法,目前处于临床前开发阶段,主要针对肝脏疾病,包括非酒精性脂肪肝(NAFLD)、非酒精性脂肪性肝炎(NASH)和2型糖尿病(T2D),以及痛风等代谢性疾病。
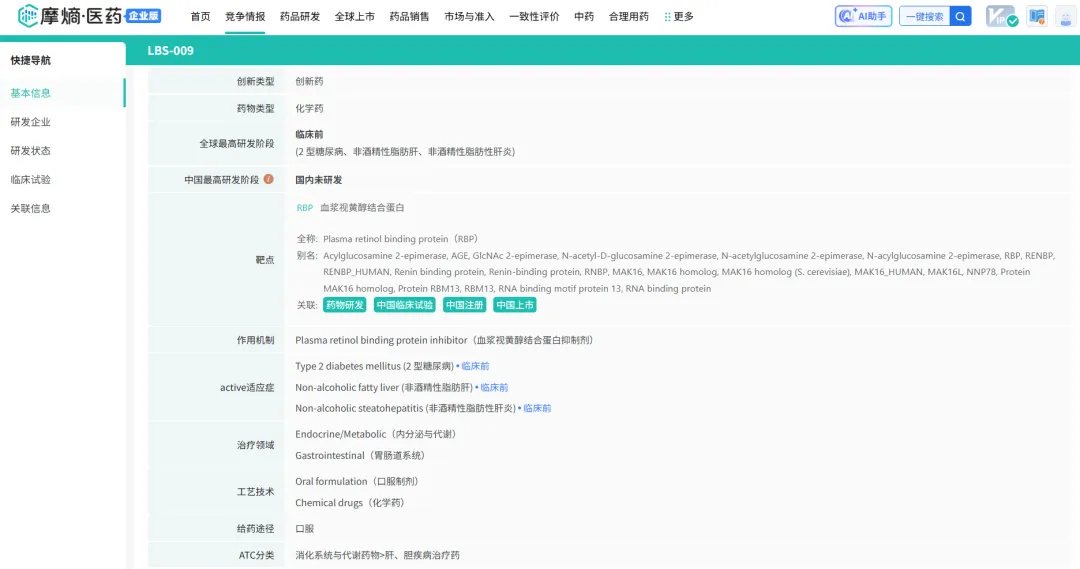
tyc7111cc太阳成集团数据库:药品研发信息
RBP4被认为是NAFLD、NASH和T2D的潜在生物标志物和治疗靶点,研究表明,RBP4水平升高与NAFLD、NASH和T2D的发展之间存在密切关联,RBP4升高可通过诱导从头脂肪生成、损害脂肪酸氧化和加剧肝脏内的胰岛素抵抗来促进肝脏脂肪堆积,从而导致这些疾病的进展。LBS-009有可能通过调节RBP4水平,改善肝脏代谢功能,减轻胰岛素抵抗,从而为这些疾病的治疗提供新的途径。虽然LBS-009尚未进入临床试验阶段,但公司在临床前研究中已取得了一些初步的积极结果,为后续的临床开发奠定了基础。
三、财务状况
截止2024年度,Belite Bio研发费用为2990万美元,与上年同期相比有所增加;一般和行政费用为1010万美元;其他收入390万美元;净亏损3610万美元,每股亏损1.18美元,而上年同期净亏损3160万美元,每股亏损1.19美元。
截止2024年12月31日,公司拥有现金3170万美元,1.135亿美元的流动资金、定期存款和美国国库券。
想要解锁更多药企信息吗?查询tyc7111cc太阳成集团(原药融云)数据库(vip.ybspc.cn/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!
































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](http://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)











 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论