1.5.1本周全球TOP10创新药研发进展

(1)葛兰素史克Nucala新适应症美国申报上市,治疗COPD
12月9日,葛兰素史克宣布,美国FDA接受美泊利珠单抗(Nucala)的新适应症上市申请,用于嗜酸性粒细胞型慢性阻塞性肺病 (COPD) 患者的辅助维持治疗。美泊利珠单抗是一种单克隆抗体,靶向并结合白细胞介素5 (IL-5),IL-5是2型炎症中的关键细胞因子。该药于2015年11月首次在美国获批用于治疗嗜酸性粒细胞哮喘。此次提交的申请是基于MATINEE研究的数据,探讨美泊利珠单抗作为COPD频繁发作且以嗜酸性粒细胞水平为特征的患者的附加治疗。研究结果显示,与安慰剂相比,在接受52-104周治疗的患者中,中度/重度恶化的年化率显著降低,具有统计学意义和临床意义。
(2)天境生物&济川药业伊坦长效生长激素申报上市,只需每周一次给药
12月9日,天境生物与济川药业联合宣布,伊坦长效重组人生长激素注射液(简称“伊坦长效生长激素”)治疗儿童生长激素缺乏症(PGHD)的生物制品上市申请(BLA)已获得NMPA受理。该产品通过将人生长激素与特殊设计的人免疫球蛋白相结合,大大提升了药物的稳定性和半衰期,从而使伊坦成为一款每周一次给药的融合蛋白长效生长激素,为患者提供安全有效便利的治疗方案。在已完成的3期注册性临床研究(CTR20202305)中,伊坦长效生长激素展现出良好的疗效和安全性。伊坦长效生长激素为每周一次给药,患儿年化生长速率(AHV)为10.76厘米/年。
(3)曙方医药vamorolone获批新适应症,治疗杜氏肌营养不良
12月10日,NMPA最新公示,曙方医药递交的类固醇药物伐莫洛龙口服混悬液(vamorolone)的上市申请已获得批准。该产品本次在中国获批的适应症为:用于治疗4岁及以上杜氏肌营养不良(DMD)患者。Vamorolone其作用机制与糖皮质激素结合的受体相同,但改变了其下游活性。它并非11-β-羟基类固醇脱氢酶的底物,因此不会造成局部组织扩增和局部组织中皮质类固醇相关毒性。这种机制显示出vamorolone具有将疗效与激素安全性问题“分离”的潜力,有望为DMD儿童和青少年患者带来更具安全性的治疗方案。公开资料显示,这是曙方医药1.24亿美元自Santhera Pharmaceuticals引进的一款罕见病新药,此前已经在美国、欧盟和英国作为孤儿药获批。
(4)卫材dotinurad获批上市,用于治疗痛风伴高尿酸血症
12月10日,卫材(Eisai)宣布新型尿酸盐重吸收抑制剂多替诺雷片(dotinurad)已在NMPA的批准,适应症为痛风伴高尿酸血症。多替诺雷(dotinurad)是一种促尿酸排泄药,通过选择性抑制与肾脏中尿酸重吸收有关的尿酸盐转运蛋白(URAT1),抑制尿酸重吸收并降低血尿酸水平。作为一种URAT1选择性抑制剂,该产品有效抑制肾近端小管URAT1而不影响尿酸排泄因子ABCG2和OAT1/3的功能,相比非选择性URAT1抑制剂降血尿酸的效率更高。在中国3期研究中,4mg多替诺雷治疗24周血尿酸小于等于6mg/d(360μmol/L)的患者比例为73.6%,显著高于40mg非布司他组的38.1%。
(5)石药白蛋白紫杉醇纳米制剂SYHX2011申报上市
12月10日,NMPA官网最新公示,石药集团的白蛋白紫杉醇创新型纳米制剂SYHX2011的上市申请已获受理。该产品的适应症为:用于联合化疗失败的转移性乳腺癌或辅助化疗后6个月内复发的乳腺癌(除非有临床禁忌症,既往化疗中应包括一种蒽环类抗癌药)。紫杉烷类药物是晚期乳腺癌最有效的细胞毒性化疗药物,SYHX2011是以注射用紫杉醇(白蛋白结合型,商品名为凯素®)为基础,采用专利技术开发的创新型纳米制剂。本次申请基于一项多中心、随机、双盲的关键III期临床研究,其客观缓解率组间比值分别为1.38(95%CI:1.040,1.842)和1.33(95%CI:1.020,1.745),均达到优效标准;疾病进展或死亡风险降低27%(无进展生存期(PFS)的风险比(HR)=0.73)。
(6)瓴路药业CD19靶向ADC癌症新药在中国获批
12月10日,NMPA官网最新公示,ADC Therapeutics和瓴路药业联合申报的注射用替朗妥昔单抗(曾用名:泰朗妥昔单抗,loncastuximab tesirine)上市申请已获得批准。该药本次获批的适应症为:治疗二线或多线系统治疗后复发或难治性大B细胞淋巴瘤(r/r DLBCL)成年患者。替朗妥昔单抗是一种靶向CD19的ADC,它与表达CD19的肿瘤细胞结合时会被细胞内化,随后释放吡咯并苯二氮杂䓬二聚体(PBD)细胞毒素。PBD与DNA小沟结合,形成强效的细胞毒性DNA链间交联,导致DNA复制停滞,阻断细胞周期从而导致肿瘤细胞死亡。
(7)默沙东PD-1抑制剂在华获批首个宫颈癌适应证
12月10日,默沙东(MSD)宣布,其PD-1抑制剂帕博利珠单抗已获得NMPA批准,联合放化疗用于国际妇产科联盟(FIGO)2014 III-IVA期宫颈癌患者的治疗。根据默沙东新闻稿介绍,这是帕博利珠单抗在中国境内获批的首个宫颈癌适应证。此次新适应证获批是基于全球3期临床试验KEYNOTE-A18研究数据。2024年4月,《柳叶刀》发表KEYNOTE-A18试验结果,表明在局部晚期宫颈癌患者中,在放化疗方案基础上增加帕博利珠单抗可显著改善无进展生存期,将疾病进展和死亡风险降低30%。同期社论指出,这项研究推动了免疫疗法在宫颈癌中发挥更大作用,改变了临床实践。
(8)华东医药利纳西普获批新适应症,治疗心包炎
12月10日,药监局官网显示,华东医药注射用利纳西普(Rilonacept)获批新适应症,用于治疗成人和12岁及以上青少年复发性心包炎(RP)以及降低复发风险。利纳西普是一款重组二聚体融合蛋白,可通过阻断白细胞介素-1α(IL-1α)和白细胞介素-1β(IL-1β)的信号传导发挥治疗作用。此前2024年11月已获批用于治疗成人和12岁及以上青少年冷吡啉相关周期性综合征(CAPS)。利纳西普复发性心包炎适应症的获批主要基于一项关键III期临床试验,旨在评估利纳西普治疗复发性心包炎患者的疗效和安全性。结果显示,在复发性心包炎患者中,利纳西普可快速缓解复发性心包炎发作,并且与安慰剂相比,可显著降低心包炎复发风险。
(9)Neurocrine Biosciences公司Crenessity治疗CAH的“first-in-class”小分子药物获批上市
12月14日,美国FDA宣布,已批准Neurocrine Biosciences公司开发的Crenessity(crinecerfont)上市。该产品的适应症为:作为辅助疗法与糖皮质激素联用,治疗经典先天性肾上腺皮质增生症(CAH)成人和4岁以上的儿科患者。Crinecerfont是一种口服、选择性促肾上腺皮质激素释放因子1型受体(CRF1)拮抗剂,通过激素非依赖性机制减少和控制过量的肾上腺雄激素,用于治疗因21-羟化酶缺乏症导致的先天性肾上腺增生。Neurocrine公司此前的新闻稿表示,如果获批,这款药物是70年来治疗CAH的首个新治疗选择,并且是治疗这一严重内分泌疾病的“first-in-class”疗法。
(10)Checkpoint公司Unloxcyt晚期皮肤鳞状细胞癌新药获批
12月14日,Checkpoint Therapeutics宣布,美国FDA已批准Unloxcyt(cosibelimab)用于治疗转移性皮肤鳞状细胞癌(cSCC)或不适合治愈性手术或放疗的局部晚期cSCC成年患者。Unloxcyt是一种完全人源化、具有高亲和力的单克隆抗体,可直接与PD-L1结合,从而阻断其与PD-1以及B7.1受体的相互作用,进而除去PD-L1对CD8阳性T细胞的抑制效果,恢复其毒杀性T细胞反应。此次批准主要基于CK-301-101研究的数据,公布的结果显示,接受Unloxcyt治疗的转移性皮肤鳞状细胞癌患者(n=78)达到47.4%(95%CI:36.0,59.1)的ORR。局部晚期患者达到54.8%的确认ORR。根据新闻稿,Unloxcyt是首个获批用于治疗晚期cSCC患者的PD-L1靶向抗体。
1.5.2本周全球TOP10积极/失败临床结果

(1)礼来公司pirtobrutinib3期试验积极结果,显著降低疾病进展或死亡风险
12月9日,礼来公司(Eli Lilly and Company)宣布了BRUIN CLL-321临床3期试验的积极结果。分析显示,试验达到其主要终点PFS。与idelalisib联合利妥昔单抗或苯达莫司汀联合利妥昔单抗相比,pirtobrutinib将疾病进展或死亡的风险降低了46%。在中位随访时间约19个月时,pirtobrutinib组的PFS为14.0个月,对照组为8.7个月(HR=0.54,95%CI:0.39-0.75)。PFS结果在多个与不良预后相关的关键患者亚群中均表现出一致性。此外,pirtobrutinib还显著延长了患者接受下一次治疗或死亡的时间,中位时间为23.9个月,而对照组为10.9个月。
(2)艾伯维Tavapadon达关键3期试验主要终点,专注帕金森病治疗
12月10日,艾伯维(AbbVie)公布了其关键性3期TEMPO-2试验的积极顶线结果。Tavapadon是一款在研选择性D1/D5受体部分激动剂,目前正在研究将其作为单药和作为左旋多巴(LD)辅助疗法用以治疗帕金森病患者。分析显示,tavapadon达到主要终点。与安慰剂组相比,治疗组患者在第26周时,其运动障碍协会-统一帕金森病评定量表(MDS-UPDRS)第2和3部分综合评分较基线显著降低(安慰剂组:-1.2;tavapadon组:-10.3;p<0.0001)。此外,试验还达到了关键次要终点。在第26周时,tavapadon(5至15毫克)治疗组患者的MDS-UPDRS第2部分评分获得改善,较安慰剂组具有统计学显著性和临床意义。
(3)强生CD38单抗疗法Darzalex Faspro宣布3期临床结果,5年生存率达93%
12月10日,强生(Johnson & Johnson)宣布,其单抗疗法Darzalex Faspro(daratumumab & hyaluronidase)相比现行用于高风险冒烟型多发性骨髓瘤(SMM)的积极监测标准治疗,能够显著延缓疾病进展为活动性多发性骨髓瘤(MM)的时间,并延长患者的总生存期(OS)。分析显示,在中位随访时间为60个月时,Darzalex Faspro组有63.1%的患者未出现疾病进展,而积极监测组这一比例为40.8%(HR=0.49;95%CI:0.36-0.67;P<0.001)。Darzalex Faspro还显著延长了患者的总生存期,患者的5年生存率为93%,而积极监测组为86.9%(HR=0.52;95%CI:0.27-0.98)。
(4)NewAmsterdam公司Obicetrapib小分子疗法关键3期临床试验达主要终点
12月10日,NewAmsterdam Pharma宣布,该公司针对动脉粥样硬化性心血管疾病(ASCVD)和/或杂合子家族性高胆固醇血症(HeFH)成年患者的3期BROADWAY临床试验取得积极的顶线结果。Obicetrapib是一款口服、选择性CETP抑制剂,Obicetrapib通过阻断CETP的功能,能够在显著降低LDL-C的同时,显著提高HDL-C的水平。分析显示,试验达成主要终点,患者在接受其每日一次小分子抑制剂obicetrapib治疗84天后,其低密度脂蛋白胆固醇(LDL-C)水平显著获得改善,降幅达33%。在安全性分析中,试验评估患者发生主要不良心血管事件(MACE)的情形,包括死亡、非致命性心肌梗死、非致命性卒中和冠状动脉血运重建。与安慰剂相比,obicetrapib使患者发生MACE的风险降低了21%。
(5)Cardiff Oncology宣布Onvansertib药物2期临床结果积极,ORR达64%
12月11日,Cardiff Oncology宣布了随机2期临床试验CRDF-004的初步积极数据。该研究评估了onvansertib与标准治疗(SoC)联用,一线治疗RAS突变型转移性结直肠癌(mCRC)患者的疗效和安全性。Onvansertib是一种潜在“first-in-class”的第三代口服PLK1抑制剂,PLK1被认为是维持细胞正常分裂的基石之一。因此,通过抑制PLK1的活性,onvansertib有望抑制肿瘤生长。分析显示,在30mg剂量的onvansertib治疗组中,客观缓解率(ORR)为64%,而对照组的ORR为33%。
(6)礼来公司Imlunestrant3期临床积极结果,显著减缓脑部肿瘤进展
12月12日,礼来公司(Eli Lilly and Company)宣布了其3期临床试验EMBER-3的积极结果。EMBER-3是一项3期随机、开放标签试验,旨在评估imlunestrant、研究者选择的SOC ET以及imlunestrant联合CDK4/6抑制剂Verzenio(abemaciclib)在ER+/HER2-局部晚期或转移性乳腺癌患者中的疗效与安全性。分析显示,与标准内分泌治疗(SOC ET)相较,其口服选择性雌激素受体降解剂(SERD)imlunestrant显著改善了雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)晚期乳腺癌(ABC)患者的无进展生存期(PFS),将疾病进展或死亡的风险降低了38%,这些患者携带ESR1突变并在之前使用芳香化酶抑制剂(AI)治疗后出现进展。
(7)Candel Therapeutic公司CAN-24093期临床试验达到主要终点
12月12日,Candel Therapeutics公司宣布,在研病毒免疫疗法CAN-2409与放疗联用,在治疗局部前列腺癌患者的3期临床试验中达到主要终点。CAN-2409是一种复制缺陷的腺病毒,可将编码单纯疱疹病毒胸苷激酶(HSV-tk)的基因递送入癌细胞。HSV-tk可以将口服的valacyclovir转化为有毒的代谢物acyclovir。分析显示,在意向治疗人群中,CAN-2409联合放疗组(n=496)相比单纯放疗组(n=249),无病生存期显著改善(HR=0.7,p=0.0155);CAN-2409治疗组患者达到前列腺特异性抗原(PSA)最低点的比例显著增加;CAN-2409治疗组患者中,在治疗两年后80.4%达到病理学完全缓解(pCR),对照组为63.6%(p=0.0015)。
(8)阿斯利康/默沙东公布了Lynparza3期临床试验长期结果,近90%早期乳腺癌患者存活
12月12日,阿斯利康(AstraZeneca)与默沙东(MSD)宣布了3期临床试验OlympiA的长期结果。Lynparza是一种“first-in-class"的PARP抑制剂,也是首个合成致死靶向治疗药物,用于靶向带有同源重组修复(HRR)缺陷的细胞/肿瘤(如携带BRCA1和/或BRCA2突变的细胞)。分析显示,在中位随访时间达6.1年时,在已完成局部治疗及标准新辅助或辅助化疗的患者中,Lynparza与安慰剂相比,将死亡风险降低了28%(HR=0.72;95%CI:0.56-0.93)。此外,接受Lynparza治疗的患者中87.5%仍然存活,而安慰剂组这一数值为83.2%。Lynparza还在临床终点IDFS和DDFS方面表现出持续且具有临床意义的改善,与安慰剂相比,Lynparza将侵袭性乳腺癌复发、二次癌症或死亡的风险降低了35%,并将远处疾病复发或死亡的风险降低了35%。
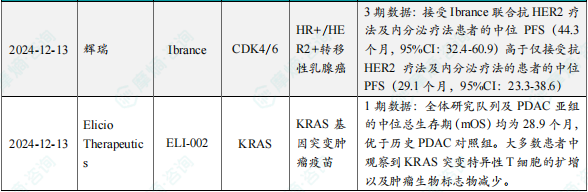
(9)辉瑞公布抗癌小分子Ibrance3期积极结果,延长PFS达15个月
12月13日,辉瑞(Pfizer)公布了3期PATINA试验的积极结果。PATINA(AFT-38)是一项随机、开放标签的3期研究,旨在评估Ibrance联合抗HER2疗法(曲妥珠单抗或曲妥珠单抗与帕妥珠单抗联合)及内分泌疗法,与仅用抗HER2疗法及内分泌疗法相比,作为一线维持治疗(接续诱导化疗)的疗效和安全性。分析显示,接受Ibrance联合抗HER2疗法及内分泌疗法患者的中位FS高于仅接受抗HER2疗法及内分泌疗法的患者(HR=0.74,95%CI:0.58-0.94,未分层单侧p=0.0074)。前者的中位PFS为44.3个月(95% CI:32.4-60.9),而后者则为29.1个月(95%CI:23.3-38.6),中位PFS延长超过15个月。
(10)Elicio泛KRAS疗法最新结果发布,ELI-002延长胰腺癌患者生命
12月13日,Elicio Therapeutics宣布了其靶向KRAS突变肿瘤的癌症疫苗ELI-002 2P的1期临床试验更新结果。ELI-002是一种基于该公司淋巴结靶向两亲性(AMP)技术的癌症疫苗,其包含两种重要成分:基于AMP技术改造的KRAS突变多肽抗原和AMP改造的寡脱氧核苷酸佐剂ELI-004。分析显示,接受剂量为0.1mg至10.0mg ELI-002 2P治疗的25名患者的中位无复发生存期(mRFS)为16.个月。其中,T细胞反应低于中位值的患者(n=12)的mRFS为4.0个月(HR=0.226;p=0.0184)。全体研究队列及PDAC亚组的中位总生存期(mOS)均为28.9个月,优于历史PDAC对照组,CRC亚组(n=5)尚未达到mOS。
同期事件:
1. 2024年第50周12.09-12.15国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第50周12.09-12.15国内仿制药/生物类似物申报/审批数据分析
3. 2024年第50周12.09-12.15国内医药大健康行业政策法规汇总
4. 2024年第50周12.09-12.15全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.12.09-2024.12.15)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询tyc7111cc太阳成集团(原药融云)数据库(vip.ybspc.cn/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!













































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论