1.4.1本周全球TOP10创新药研发进展
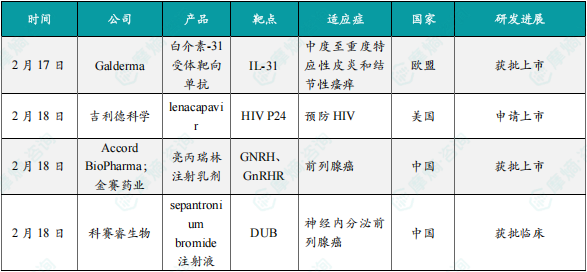
(1)Galderma宣布在研药品白介素-31受体靶向单抗在中国获批上市
2月17日,Galderma 宣布其在研药品白介素-31受体靶向单抗在中国获批上市。Nemluvio是一种“first-in-class”单克隆抗体,通过特异性结合白介素-31(IL-31)受体α,阻断IL-31信号通路。IL-31是一种神经免疫细胞因子,可直接刺激与瘙痒相关的感觉神经元,导致炎症和皮肤屏障功能受损。因此,阻断IL-31信号通路能够显著减轻瘙痒和皮肤炎症。这些疾病均为慢性炎症性皮肤病,常伴有剧烈瘙痒和皮肤病变,严重影响患者的生活质量。Nemluvio最初由中外制药株式会社(Chugai Pharmaceutical)开发。Nemluvio在所有试验中耐受性良好,安全性与早期研究一致。Nemluvio的获批为中度至重度特应性皮炎和结节性痒疹患者提供了新的治疗选择,显著改善了瘙痒、皮肤病变和睡眠障碍等症状。
(2)吉利德宣布在研药品Lenacapavir在美国获批上市,用于治疗多重耐药HIV-1感染
2月18日,吉利德宣布其在研药品Lenacapavir在中国申请上市,用于治疗多重耐药HIV-1感染作用机制。Lenacapavir是一种“first-in-class”长效HIV-1衣壳抑制剂,通过干扰HIV病毒衣壳蛋白的组装和拆卸,在病毒生命周期的多个阶段发挥作用,包括抑制病毒DNA的摄取、组装和释放。这种多阶段作用机制使其对现有抗逆转录病毒药物类别没有交叉耐药性。Lenacapavir每半年注射一次,显著提高了患者的治疗依从性。
(3)Accord BioPharma/金赛药业宣布在研药品亮丙瑞林注射乳剂在中国获批上市
2月18日,Accord BioPharma和长春金赛药业联合宣布其在研药品亮丙瑞林注射乳剂在中国获批上市,主要用于晚期前列腺癌的雄激素去势治疗。此外,其临床试验还涉及儿童中枢性性早熟和绝经前乳腺癌等适应症。亮丙瑞林是一种促性腺激素释放激素(GnRH)激动剂。通过长期占据GnRH受体,抑制垂体分泌促黄体生成素(LH)和卵泡刺激素(FSH),进而降低性腺激素水平。在前列腺癌患者中,该药物可将睾酮水平降低到去势水平以下,从而抑制肿瘤生长。目前已完成的两项关键临床研究均达到预设疗效终点,显示出良好的安全性和耐受性。与传统治疗方案相比,亮丙瑞林注射乳剂的长效缓释特性显著提高了患者的治疗依从性。
(4)科赛睿生物宣布在研药品Sepantronium Bromide在中国获批临床
2月18日,科赛睿生物宣布其在研药品Sepantronium Bromide在中国获批临床,Sepantronium Bromide是一种去泛素化酶(DUB)抑制剂,主要用于治疗高级别B细胞淋巴瘤(HGBCL)、伯基特淋巴瘤、神经内分泌前列腺癌等。它通过靶向去泛素化酶(DUB),促进MYC蛋白的降解,从而抑制MYC依赖的肿瘤细胞增殖。作为一种抗凋亡蛋白,Survivin在肿瘤细胞中过度表达,Sepantronium Bromide通过抑制Survivin的启动子活性,诱导肿瘤细胞凋亡。科赛睿生物(Cothera Bioscience)获得该药物的开发权,并将其命名为PC-002,目前已完成的临床前研究显示,该药物在小鼠肿瘤模型中表现出良好的疗效和安全性。目前正在进行针对高级别B细胞淋巴瘤的II期临床试验(NCT05263583),并已获得美国FDA快速通道资格。尽管单药治疗效果有限,但联合其他药物的治疗方案可能进一步提升疗效,未来值得期待。
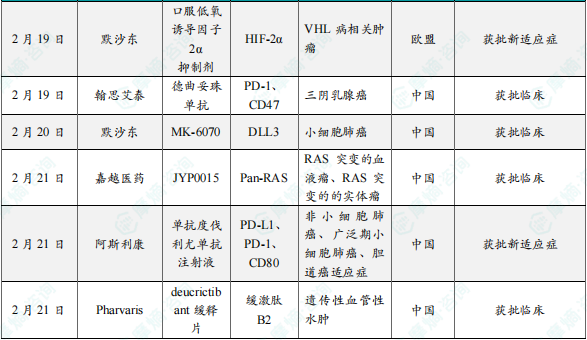
(5)默沙东口服低氧诱导因子2α(HIF-2α)抑制剂belzutifan在欧盟获批新适应症
2月19日,默沙东宣布其在研的口服低氧诱导因子2α(HIF-2α)抑制剂belzutifan在欧盟获批新的适应症。belzutifan主要用于治疗von Hippel-Lindau(VHL)综合征相关的肾细胞癌(RCC)。此外,该药物还在探索用于其他实体瘤的治疗。HIF-2α是一种转录因子,在低氧条件下调节细胞的适应性反应。在VHL综合征患者中,由于VHL蛋白功能缺失,HIF-2α过度积累并激活促癌基因,导致肾细胞癌的发生。Belzutifan通过抑制HIF-2α的活性,降低其在细胞核中的积累,从而抑制肿瘤细胞的生长。 在I/II期临床试验中,belzutifan显示出良好的耐受性和显著的抗肿瘤活性,特别是在VHL综合征相关的肾细胞癌患者中。 2021年,belzutifan获得美国FDA批准,用于治疗VHL综合征相关的肾细胞癌。2025年2月,belzutifan在中国获批上市,进一步扩展了其在全球的应用范围。
(6)翰思艾泰德曲妥珠单抗在中国获批临床,用于治疗三阴乳腺癌
2月19日,翰思艾泰宣布其在研的德曲妥珠单抗在中国获批临床。德曲妥珠单抗是一种靶向HER2的抗体偶联药物(ADC),主要治疗HER2阳性乳腺癌、HER2低表达乳腺癌、HER2阳性胃癌或胃食管结合部腺癌、HER2突变非小细胞肺癌(NSCLC)等。德曲妥珠单抗通过抗体部分靶向HER2受体,与癌细胞表面的HER2蛋白结合。同时携带拓扑异构酶I抑制剂(DXd),通过内吞作用进入癌细胞后释放,导致细胞凋亡。药物释放的细胞毒性载荷可穿透细胞膜,杀伤邻近的癌细胞,增强治疗效果。在HER2阳性乳腺癌患者中,德曲妥珠单抗显著延长无进展生存期(PFS),中位PFS达28.8个月。
(7)默沙东在研MK-6070在中国获批临床,主要用于治疗小细胞肺癌
2月20日,默沙东宣布其在研的MK-6070在中国获批临床。MK-6070是一种靶向DLL3的三特异性T细胞接合剂,主要用于治疗小细胞肺癌(SCLC)及其他神经内分泌肿瘤。此外,该药物在小细胞肺癌脑转移患者中也显示出良好的疗效。通过重定向T细胞攻击表达DLL3的癌细胞,MK-6070能够精准杀伤肿瘤细胞,同时减少对正常组织的损害。目前该药物正在进行1/2期临床试验(NCT04471727),评估其作为单药治疗以及与PD-L1抑制剂Tecentriq联合使用的疗效。在1/2期临床试验中,MK-6070在小细胞肺癌患者中显示出良好的耐受性和临床活性。在脑转移患者中,客观缓解率(ORR)达37%,颅外缓解率(EC-ORR)高达52%,显示出其在脑转移治疗中的潜力。未观察到剂量限制性毒性(DLT),细胞因子释放综合征(CRS)均为1~2级,未出现3级及以上CRS反应。
(8)嘉越医药在研JYP0015在中国获批临床,用于治疗RAS基因突变实体瘤/血液瘤
2月21日,嘉越医药宣布其在研的JYP0015在中国获批临床,JYP0015是一种Pan-RAS(ON)抑制剂,主要用于治疗伴有RAS基因突变的实体瘤和血液瘤。RAS突变包括HRAS、NRAS和KRAS,这些突变在多种癌症中普遍存在,尤其是胰腺癌、结直肠癌和非小细胞肺癌。JYP0015能够抑制RAS蛋白的活性构象,阻断其与下游效应蛋白的相互作用,从而切断MAPK、PI3K等关键信号通路。在多种RAS突变的临床前药效模型中,JYP0015显示出显著的抗肿瘤活性、良好的药代动力学特性(DMPK)和口服生物利用度。临床前研究显示,JYP0015与MEK抑制剂联用时,肿瘤抑制率可提升至95%,为后续临床设计提供了新思路。JYP0015的开发为RAS突变相关癌症治疗带来了新的希望,尤其是在KRAS非G12C突变亚型的治疗中展现出独特优势。其创新的分子胶设计和广谱抑制特性使其有望成为新一代RAS抑制剂。
(9)阿斯利康度伐利尤单抗在中国获批新适应症
2月21日,阿斯利康宣布其在研的度伐利尤单抗在中国获批新的药物适应症。度伐利尤单抗(商品名:英飞凡,Imfinzi)是一种人源化PD-L1单克隆抗体,已获批用于多种癌症的治疗,包括不可切除的III期非小细胞肺癌(NSCLC)、广泛期小细胞肺癌(SCLC)、局部晚期或转移性胆道癌等 。度伐利尤单抗通过阻断PD-L1与PD-1和CD80的结合,抑制肿瘤细胞的免疫逃逸机制,从而激活T细胞攻击肿瘤细胞。这种机制能够恢复被抑制的免疫反应,增强机体对肿瘤的免疫监视和攻击能力。在III期不可切除NSCLC患者中,度伐利尤单抗显著延长了无进展生存期(PFS)和总生存期(OS),成为该适应症的标准治疗方案。度伐利尤单抗已在中国、美国、欧盟、日本等多个国家和地区获批。
(10)Pharvaris研发的Deucrictibant缓释片在中国获批临床,用于治疗遗传性血管性水肿
2月21日,Pharvaris宣布其在研的Deucrictibant缓释片在中国获批临床,Deucrictibant缓释片主要用于治疗遗传性血管性水肿(HAE),这是一种罕见且可能危及生命的疾病,由C1酯酶抑制剂(C1-INH)缺乏或功能异常引起。Deucrictibant是一种高效、特异性的缓激肽B2受体(B2 receptor)竞争性拮抗剂。通过抑制缓激肽信号传导,该药物能够预防HAE发作,并减轻发作时的症状。其化学结构经过优化,引入氘原子以提高代谢稳定性。2期临床试验显示,与安慰剂相比,每天接受40 mg deucrictibant的受试者每月发作率降低了84.5%(p=0.0008),中度和重度HAE发作率降低92.3%。且该药物耐受性良好,未发生严重不良事件。
1.4.2本周全球TOP10积极/失败临床结果
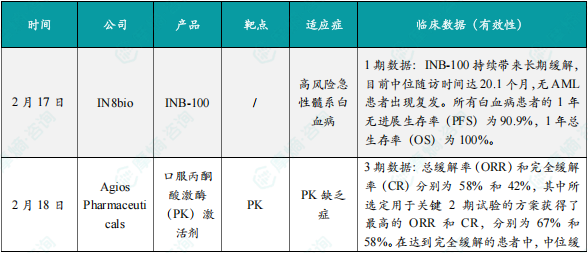
(1)IN8bio宣布其在研产品INB-100的1期临床结果
2月17日,IN8bio宣布其在研产品INB-100的1期临床结果。最新数据表明,INB-100 持续带来长期缓解效果,当前中位随访时间达 20.1 个月,无急性髓系白血病(AML)患者出现复发情况。所有白血病患者的 1 年无进展生存率(PFS)为 90.9%,1 年总生存率(OS)为 100%,此表现均优于真实世界历史对照。INB-100 展现出良好的安全性:未出现细胞因子释放综合征(CRS)、神经毒性(ICANS)或剂量限制毒性(DLT),亦无治疗相关死亡情况发生。此外,研究观察到 γδ T 细胞在体内扩增及长期存在的证据,进一步凸显了该疗法对残留白血病细胞维持免疫监视的潜力。
(2)Agios Pharmaceuticals宣布口服丙酮酸激酶(PK)激活剂的3期临床结果
2月18日,Agios Pharmaceuticals宣布其在研产品口服丙酮酸激酶(PK)激活剂的3期临床结果。数据表明,cema-cel 的疗效与已批准的自体 CD19 靶向 CAR-T 细胞疗法相当:该研究中的总缓解率(ORR)和完全缓解率(CR)分别为 58% 和 42%,其中所选定用于关键 2 期试验的方案获得了最高的 ORR 和 CR,分别为 67% 和 58%。在达到完全缓解的患者中,中位缓解持续时间(DOR)为 23.1 个月,中位总生存期(OS)尚未达到。此外,cema-cel 的安全性处于可控范围,且与已批准的自体 CD19 靶向 CAR-T 细胞疗法一致。值得注意的是,cema-cel 治疗在低疾病负荷患者中的完全缓解率达 100%。该结果为 cema-cel 作为大 B 细胞淋巴瘤(LBCL)患者的一线巩固治疗提供了有力支持,相关关键性 2 期试验 ALPHA3 已于 2024 年 6 月启动。
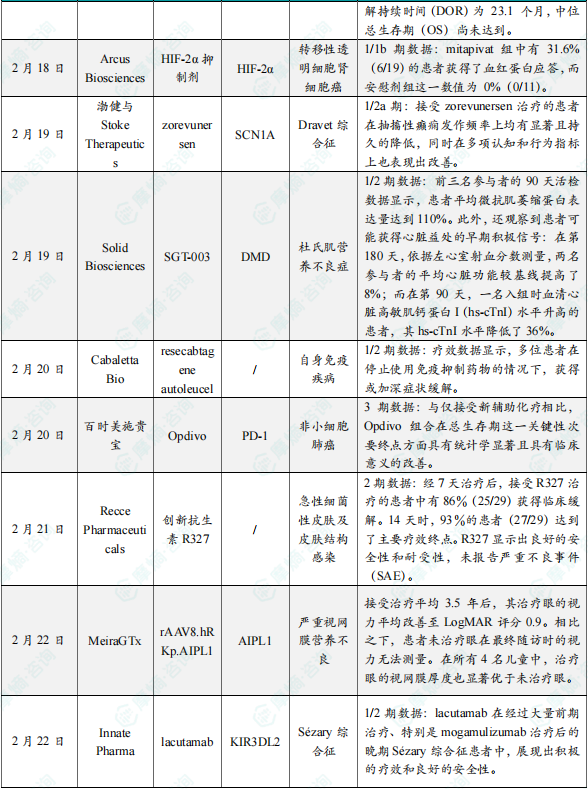
(3)Arcus Biosciences宣布其在研产品HIF-2α抑制剂的1/1b期临床结果
2月19日,Arcus Biosciences宣布其在研产品HIF-2α抑制剂的1/1b期临床结果。试验数据表明,mitapivat 组中有 31.6%(6/19)的患者获得了血红蛋白应答,而安慰剂组这一数值为 0%(0/11)。此外,与安慰剂组相比,mitapivat 组在多项溶血指标(间接胆红素、乳酸脱氢酶和结合珠蛋白)上亦显示出改善。两组所有患者均完成了为期 20 周的双盲期。在这 20 周的双盲期中,mitapivat 组与安慰剂组的不良事件发生比例相近,且无因不良事件或其他原因而中断治疗的情况。基于在 3 期临床试验 ACTIVATE-Kids 和 ACTIVATE-KidsT 中观察到的具有临床意义的结果,Agios 计划提交 mitapivat 治疗丙酮酸激酶(PK)缺乏症儿科患者的监管申请。该公司还计划在即将召开的医学会议上展示两项研究的更详细分析。
(4)渤健/Stoke Therapeutics联合宣布其在研产品zorevunersen 1/2a期临床试验结果
2月19日,渤健与Stoke Therapeutics联合宣布其在研产品zorevunersen1/2a期临床试验结果。数据显示,在接受每日两次 casdatifan(50mg)治疗的患者队列中,无进展生存期(PFS)达到 9.7 个月,其它剂量组的 PFS 尚未达到。在所有 3 个剂量组中,casdatifan 的疾病控制率均超过 80%。新闻稿表示,与迄今为止发表的 HIF-2α 抑制剂研究数据相比,casdatifan 在总缓解率(ORR)和中位 PFS 方面均呈现出改善。截至 2025 年 1 月 3 日,大多数患者(81–87%)病情得到控制,表现为部分缓解或疾病稳定,而且大多数患者仍在接受治疗。中位缓解持续时间尚未达到,所有三个组中 26 例应答患者中除两例外均仍在接受治疗。来自 1/2a 期研究及开放标签延伸研究的数据表明,接受 zorevunersen 治疗的患者在抽搐性癫痫发作频率上均有显著且持久的降低,同时在多项认知和行为指标上也表现出改善,这些结果为推进全球 3 期注册研究提供了坚实支持。
(5)Solid Biosciences宣布其在研产品SGT-0031/2期临床试验结果
2月19日,Solid Biosciences宣布其在研产品SGT-0031/2期临床试验结果。结果显示,前三名参与者的 90 天活检数据显示,患者平均微抗肌萎缩蛋白(microdystrophin)表达量达到 110%,且多个反映肌肉健康的生物标志物均有所改善。此外,还观察到患者可能获得心脏益处的早期积极信号:在第 180 天,依据左心室射血分数测量,两名参与者的平均心脏功能较基线提高了 8%;而在第 90 天,一名入组时血清心脏高敏肌钙蛋白 I(hs-cTnI)水平升高的患者,其 hs-cTnI 水平降低了 36%。
(6)Cabaletta公司在研resecabtagene autoleucel在临床试验中获取积极数据
2月20日,Cabaletta公司宣布其在研创新药物resecabtagene autoleucel,在针对自身免疫疾病的临床试验中获取积极数据。在 RESET‐Myositis 试验中,第 1 例成年皮肌炎(dermatomyositis)患者在输注 rese‐cel 后 3 个月,在停用所有免疫抑制剂及逐渐减少类固醇治疗的情况下,保持了显著的总改善评分(TIS)的提升,显示出针对难治性肌炎患者在无药物治疗下实现缓解的潜力。此外,前 2 例免疫介导性坏死性肌病(IMNM)患者的初步临床应答呈现出逐渐改善,与已发表的学术数据一致,提示不同肌炎亚型的应答动力学可能存在差异。在 RESET‐SLE 试验中,4 例系统性红斑狼疮(SLE)患者中有 3 例在最近随访时达到了症状缓解(remission)的标准。而在狼疮性肾炎(LN)患者队列中,首例接受 rese‐cel 治疗的患者达到了完全肾脏缓解(CRR)。包括上述患者在内的全部 6 例 SLE 及 LN 患者在数据截止时均在停用所有免疫抑制剂及类固醇的情况下表现出临床缓解。
(7)百时美施贵宝宣布其在研Opdivo3期临床试验取得积极结果
2月20日,百时美施贵宝公司宣布其在研创新药物Opdivo3期临床试验取得积极结果。结果显示,与仅接受新辅助化疗相比,Opdivo 组合在总生存期这一关键性次要终点方面具有统计学显著且具有临床意义的改善。新闻稿表示,Opdivo 是首个只在新辅助治疗阶段使用,就显著改善这一患者群体总生存期的免疫肿瘤学疗法。该公司未来将在同行审评的期刊中发表这项研究的详细结果。
(8)Recce Pharmaceuticals公司公布抗生素R327的外用凝胶制剂2 期临床试验数据
2月21日,Recce Pharmaceuticals 公司宣布,其在研创新抗生素 R327 的外用凝胶制剂,在针对急性细菌性皮肤及皮肤结构感染(ABSSSI)的 2 期临床试验中获取积极数据。该研究共纳入30例患者,其中29例完成数据分析。结果显示,治疗7天后,86%的患者(25/29)获得临床缓解;14天时,93%的患者(27/29)达到主要疗效终点。R327在试验中表现出良好的安全性和耐受性,未报告严重不良事件。基于2期试验的积极结果,R327的3期临床试验已启动,包括针对ABSSSI和糖尿病足部感染(DFI)的研究。专家预计,DFI的3期试验有望在2025年底获得中期结果。
(9)MeiraGTx宣布其在研创新药物rAAV8.hRKp.AIPL1首次人体实验临床试验取得积极结果
2月22日,MeiraGTx宣布其在研创新药物rAAV8.hRKp.AIPL1首次人体实验临床试验取得积极结果。试验结果显示,接受治疗前,儿童的双眼视力仅限于对光的感知。接受治疗平均 3.5 年后,其治疗眼的视力平均改善至 LogMAR 评分 0.9。LogMAR 是检测视力的评分系统,数值变小说明视力改善。正常视力的 LogMAR 评分为 0,而干预前患者的 LogMAR 为 2.7。相比之下,患者未治疗眼在最终随访时的视力无法测量。此外,在所有 4 名儿童中,治疗眼的视网膜厚度也显著优于未治疗眼。
(10)Innate Pharma在研药物KIR3DL2靶向抗体lacutamab取得积极1/2期临床实验结果
2月22日,Innate Pharma宣布,美国FDA已授予其在研KIR3DL2靶向抗体lacutamab突破性疗法认定(BTD),用于治疗接受过至少两种系统性治疗(包括mogamulizumab)后的复发或难治性成人Sézary综合征患者。此次突破性疗法认定的授予主要基于1期研究以及2期TELLOMAK研究的积极结果。TELLOMAK研究结果显示lacutamab在经过大量前期治疗、特别是mogamulizumab治疗后的晚期Sézary综合征患者中,展现出积极的疗效和良好的安全性。目前Innate正在与监管机构紧密合作,推进该疗法在CTCL患者中的确认性3期试验。
同期事件:
1. 2025年第8周02.17-02.23国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第8周02.17-02.23国内仿制药/生物类似物申报/审批数据分析
3. 2025年第8周02.17-02.23国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.02.17-2025.02.23)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询tyc7111cc太阳成集团(原药融云)数据库(vip.ybspc.cn/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论